広報・広聴活動
オタマジャクシからカエルへの変態に伴う幽門括約筋形成のしくみ
2024年10月29日
■研究体制
京都産業大学、東京大学、帝京大学、お茶の水女子大学、基礎生物学研究所、日本医科大学生物学教室、中央大学の共同研究グループ
■発表論文
「Histological and gene-expression analyses of pyloric sphincter formation
during stomach metamorphosis in Xenopus laevis」
(アフリカツメガエルの胃の変態における幽門括約筋形成の組織学と遺伝子発現解析)
■本件のポイント
◆ 多くのカエル類では、オタマジャクシからカエルへの変態に伴って草食性から肉食性へと食性が変化し、その過程で胃と腸を区画化する幽門括約筋が形成されることが知られていたが、そのしくみは不明であった。
◆ アフリカツメガエル(Xenopus laevis)における幽門形成過程の詳細な形態観察に加えて、in situ hybridization※1による遺伝子発現解析や、RNA-seq法による時期領域特異的かつ網羅的な遺伝子発現解析を行い、変態期に幽門括約筋形成が誘導されるしくみに迫った。
◆ 幽門括約筋形成の正確な時期と場所を特定したほか、変態期に胃の後方で発現変動する遺伝子を多数発見した。その結果、幼生期にはレチノイン酸※2シグナルが幽門括約筋形成を抑制し、変態期にその抑制が解除されることで幽門括約筋形成が始まる可能性が示された。
概要
脊椎動物の消化管は食性に応じて多様な形態に進化しています。多くのカエル類では、幼生(オタマジャクシ)から成体(カエル)への変態に伴い、食性が草食性から肉食性へと変化します。変態期においては、肉食性に応じて腸の長さは4分の1に短縮し、腸管上皮は絨毛で覆われ、胃では蛋白質分解酵素のペプシンが分泌されるようになり、胃と腸を区画化する幽門括約筋が形成されます。これまで腸の変態の分子機構は盛んに研究されてきましたが、胃の変態の分子的研究はほとんどなく、特に、胚発生期※3や幼生期ではなく変態期に幽門括約筋形成が誘導されるしくみは未解析でした。
今回、東京大学大学院理学系研究科の名倉京大学院生(研究当時)と池田貴史大学院生(研究当時、現京都産業大学タンパク質動態研究所研究員)、平良眞規准教授(研究当時、現中央大学)らの研究グループは、アフリカツメガエル(Xenopus laevis)における幽門括約筋形成過程の詳細な形態観察を行い、幽門括約筋の形成位置や発達の過程を正確に記載しました。さらに、前変態期と変態最盛期の網羅的遺伝子発現解析から、幽門括約筋形成に関与する可能性のある転写因子※4を多数同定したほか、レチノイン酸シグナルの制御が変態期特異的な幽門括約筋形成に重要である可能性を新たに見出しました(図1)。
本研究成果は、カエル類の変態とそれに伴う形態形成の新たなメカニズムを提唱するほか、食性に応じた消化管形態の多様化という進化生物学上の難問に答える手がかりを与えると期待されます。
本研究成果は2024年9月21日、米国発生生物学会の機関誌「Developmental Biology」にオンラインで掲載されました。
■背景
わたしたちの消化管は、食道や胃、小腸、大腸というように、かたちや機能が異なる領域に分かれています。こうした領域性は、食べ物を効率的に消化し、栄養を吸収するためにとても重要です。たとえば、胃においては、強酸性の胃液や酸性条件下でタンパク質を分解するペプシンという消化酵素が分泌されて、食道を通って胃に運ばれてきた食べ物にふくまれるタンパク質を消化し、小腸へと送り込みます。胃の両端には、括約筋と呼ばれる厚い筋層が存在します。括約筋は刺激に応じて開閉し、食道や小腸(十二指腸)と胃を区画化するためにはたらいています。
一方で、わたしたちヒトを含む脊椎動物の消化管の構造は、食性に応じてさまざまに多様化していることが知られています。特に、多くのカエル類では、幼生(オタマジャクシ)が草食性で、成体(カエル)が肉食性というように、幼生と成体が異なる食性をもち、それに応じて消化管の形態も大きく異なります(図1)。オタマジャクシは草食性に適した長い小腸と単純な形態の胃をもちますが、カエルでは小腸は短くなり、胃の形態も複雑化しています。そのなかでも、胃の後端にある幽門括約筋は、草食性のオタマジャクシの胃には見られず、肉食性のカエルの胃ではよく発達しているという、興味深い性質を持ちます。羊膜類(哺乳類と鳥類)においては、幽門括約筋は胚発生期に作られます。つまり、羊膜類とカエル類では、幽門括約筋形成のタイミングが異なっているのです。このような、種間での発生過程の時間的な違いを、進化発生生物学では「異時性(heterochrony)」と呼びます。カエル類において幽門括約筋が異時性に形成されるしくみを明らかにすれば、脊椎動物における食性に応じた消化管構造の多様性を生みだすメカニズムの解明につながると考えられます。
では、幽門括約筋の形成をはじめとした、カエル類の変態期における消化管の作り替え(リモデリング)はどのようにして行われているのでしょうか?カエル類の変態期には、変態ホルモンとして作用する甲状腺ホルモン(thyroid hormone: TH)※5が消化管を含む全身の器官に働きかけ、さまざまなリモデリングが行われます。腸の変態の分子的解析は、本論文の共著者の岡-石津谷敦子博士と長谷部孝博士のグループおよび米国NIH(National Institutes of Health)のYun-Bo Shi博士のグループなどにより、盛んに研究されてきました。彼らの解析により、変態ホルモンであるTHにより、腸では分泌性因子のShhやBMP4が発現誘導され、それが引き金となってリモデリングが進むことが示されていました。しかし、変態に伴う胃のリモデリングの分子的しくみはほとんど解析されておらずよくわかっていませんでした。特に、幽門括約筋が変態期になって初めて形成されるしくみについては、それがどのような過程を経て開始し進行するのか、それらに関与する遺伝子は何かなど、さまざまな問いが未解析のまま残されていました。
■研究成果
【アフリカツメガエルの変態に伴う幽門括約筋形成過程の形態学的解析】
カエル類の変態期における幽門括約筋形成のしくみを明らかにするため、モデル動物※6としてよく使われているアフリカツメガエルXenopus laevisを用いて、胚発生期から変態後にいたる各発生段階の胃の形態観察を行い、幽門括約筋がいつどの位置に作られるかを検討しました。その結果、幽門括約筋は変態最盛期の胃において、予想外にも幼生型の胃の後端ではなく、胃の長い後方部(幽門領域)の中央付近の湾曲した部分(幽門湾曲部と命名)に形成され始めることがわかりました(図2;図1も参照)。幼生型の胃では幽門領域が長くなっているのが特徴で、変態前には薄い縦走筋と環状筋しかもちませんが、変態最盛期になると背側(湾曲の内側)の環状筋層がまず厚くなり始め、その肥厚が徐々に腹側(湾曲の外側)に広がっていくことも明らかになりました。そして、さらに変態が進行すると、幽門湾曲部より後方の領域が短縮し、幽門括約筋が胃の後端に位置するようになりました。このような詳細な形態学的解析から、アフリカツメガエルにおける幽門括約筋の形成時期と位置を突き止めることができました。
【幽門括約筋形成に関わる遺伝子の発現解析】
次に、アフリカツメガエルにおける幽門括約筋形成に関わる遺伝子を探索しました。羊膜類(ニワトリとマウス)とアフリカツメガエルにおいては、胃と腸それぞれに特異的に発現する遺伝子が同定されています。また、羊膜類では幽門部特異的に発現し幽門括約筋の形成に関与する遺伝子も多数知られていました。そこで、これらの遺伝子がアフリカツメガエルの胚発生期から変態期にかけてどのような発現パターンを示すかを、全胚および切片を用いたin situ hybridizationによって調べました。興味深いことに、羊膜類で腸特異的に発現するとされるcdx2の発現は、アフリカツメガエルにおいては胚発生期から幼生期および前変態期にかけて、腸に加えて胃の後方でも検出され、胃特異的に発現するbarx1と重複して発現することが明らかになりました(図3)。このbarx1とcdx2の重複発現は変態最盛期でも見られましたが、変態後にはcdx2が腸でのみ発現するようになりました。このように幽門括約筋の形成は、barx1とcdx2の重複発現している領域内であることから、どのような分子メカニズムで幽門括約筋の形成場所が決められているのかが今後の課題として残されました。
さらに、sox9やbmp4、nkx2-5、nkx3-2、gata3、grem1といった、羊膜類の幽門部に発現し括約筋の形成に関与する各種遺伝子の発現解析を行ったところ、どの遺伝子も胚発生期から前変態期にかけて既に発現していることがわかりました(図4)。つまり、これらの遺伝子は幽門括約筋の形成前から発現していたのです。このことは、変態期における異時性の幽門括約筋形成は、これまで羊膜類で知られていた遺伝子とは異なる、未知の遺伝子の機能による可能性が高いことを示唆しました。
そこで、アフリカツメガエルの幽門括約筋形成に関与する新規遺伝子を探索するため、multi-regional RNA-seq法※7を用いた網羅的な遺伝子発現解析を行いました。前変態期と変態最盛期の消化管を単離し、前後軸に沿って複数の領域に切り分けてRNA-seq法を適用し、それぞれの領域で変態に伴って発現量が上昇したり減少したりする遺伝子を探しました。すると、変態に伴って特に胃の後方(幽門括約筋形成位置の近く)で発現が上昇する転写因子が複数同定されました(図5)。これらの転写因子は、羊膜類においても幽門括約筋形成に関与するという報告がない新規遺伝子でした。また、反対に変態に伴って発現が低下する転写因子も多く見つかりました。この中には転写抑制因子として機能するfoxq1などが含まれており、変態前に幽門括約筋が形成されてしまうのを防ぐ働きがあるのかもしれず今後の課題になりました。
また、上記遺伝子以外にも、発生シグナルとして重要なレチノイン酸の産生に関わる遺伝子が変態に応じて発現変動することもわかりました(図5)。特に、胃の後方部においては、レチノイン酸合成酵素であるaldh1a1の発現が変態に伴って減少し、反対にレチノイン酸分解酵素であるcyp26b1の発現は増強していました。このことは、胃の後方部におけるレチノイン酸のレベルが変態期に低下することを示唆しています。したがって、レチノイン酸が変態前の幽門括約筋形成を抑制し、変態に伴ってレチノイン酸分解が進むことにより幽門括約筋形成が開始する、という新たなモデルが考えられました。
■今後の展望
本研究で、カエル類の変態期において、幽門括約筋が異時性に形成されるしくみの一端を明らかにすることができました。今回私たちが同定した、変態に伴って発現量が変動する遺伝子の中には、変態期に幽門括約筋形成を促進したり、反対に変態前に幽門括約筋形成を抑制したりする遺伝子が多く含まれることが期待されます。今後これらの遺伝子が羊膜類で同定されている幽門括約筋形成関連遺伝子とどのような上下関係にあるか、またレチノイン酸シグナルとどのようにつながるかが重要な点です。加えて、前変態期にレチノイン酸シグナル伝達の阻害因子を加えると幽門括約筋形成が早まるのか、逆に変態最盛期にレチノイン酸を加えると幽門括約筋形成が阻害されるのか、早急に調べたいところです。以上のような研究から、今後、カエル類における異時性の幽門括約筋形成の詳細なしくみがさらに明らかになると考えられます。
幽門括約筋の形成異常は肥厚性幽門狭窄症をはじめ、ヒトの病気の原因となります。本研究を手掛かりとして幽門括約筋を形成するしくみがさらに詳しく明らかになれば、これらの病気の原因解明や治療に役立つことも期待されます。
■責任著者コメント
私が指導教員となれる最後の修士課程の学生が名倉京さんと池田貴史さんでした。修士論文のテーマは最後の学生ということもあり、修士課程の2年間を自ら自由な発想で進められることを期待して両人自身に考えてもらいました。しばらくして名倉さんが持ってきたテーマが「草食性のオタマジャクシから肉食性のカエルに変態するときに形成される胃の幽門括約筋の形成の分子メカニズム」でした。しかし両生類の変態は私の専門外であったことから、アフリカツメガエルで腸の変態を長年研究している、また私の出身大学院の後輩でもある、日本医科大学の岡-石津谷敦子さんに相談したところ、胃の変態に関してはほとんど研究されていないので是非進めて見ると良いでしょう、とのことで、名倉さんと二人三脚で本プロジェクトを開始しました。名倉さんの直接の実験指導は大学院生の佐藤夢子さんにお願いしました。胃の切片in situ hybridizationは日本医科大学の岡さんと長谷部孝さんにご指導をお願いしました。その後、RNA-seq解析へと発展させるところで、別のテーマで研究を進めていた池田さんにも協力してもらい、基礎生物学研究所の重信秀治さんに協力を仰ぎ、また東京大学理学部三崎臨海実験所・近藤真理子准教授の修士課程の学生の宇田川澄生さんも加わり、前変態期と最盛期の領域別のRNA-seqデータの構築と解析をすることができました。名倉さんと池田さんが修士課程を終えた後は、私と3人でオンライン会議を繰り返して論文の執筆を進めましたが、5年以上の歳月がかかりました。その間、特に難しかった点は、RNA-seqデータから如何に意味のある結論を導き出せるかということでした。また胃の切片の断片的な情報から如何に全体像を構築して幽門括約筋の場所を特定するかという点も難しく、形態学が専門の岡さんと長谷部さんと幾度も議論を交わしました。一通り論文の形になってからも共著者の方々と議論と推敲を重ねました。さらに論文のcritical reading と英語校正は近藤さんに多大なるご協力を得ましたのでAcknowledgmentsに謝意を表しました。このように多くの方々と長年にわたって仕上げた論文がようやく公表できたことは大変な喜びであるとともに、内容的にも胃の変態の分子的解析という大変ユニークなテーマであり、修士課程の学生が行った2年間のデータであるにもかかわらず、そこから得られた成果は素晴らしく、今後の研究の方向性を示すものにもなっていることで、プレスリリースとして広く公表するに値するものと思っています。
■用語・事項の解説
※1 in situ hybridization
組織や胚において、目的の遺伝子が発現する(つまりRNAに転写される)場所を可視化する手法。RNAと相補的な配列をもつプローブを用意し、組織内のRNAと結合(ハイブリダイズ)させて検出する。
※2 レチノイン酸
ビタミンAを誘導体とし、レチナールデヒドロゲナーゼ(Aldh1a1)によって合成される小分子化合物。動物の発生において、前後軸の形成などさまざまな現象にかかわる重要なシグナル分子で、核内受容体の一種であるレチノイン酸受容体(RAR)に結合して下流の遺伝子発現を制御する。レチノイン酸はCyp26により分解され活性を失う。
※3 胚発生期
発生段階の中で、孵化までの時期か、あるいは摂餌開始前の時期。どちらの定義をとるかは種によって異なる。いずれにせよ形態形成がおこり多くの器官の原基がつくられる時期である。アフリカツメガエルでは、孵化した後も形態形成が進行するので、胚に口が開いて摂餌行動を始めるオタマジャクシとなるまでの時期とする。
※4 転写因子
DNAに直接結合し、遺伝子の転写を制御する機能をもつタンパク質。発生や細胞分化においては、異なる組織や細胞に異なる転写因子が発現し、それが結合する標的遺伝子の発現を促進または抑制することで細胞の分化の方向や最終分化を決定するなどの機能が知られる。
※5 甲状腺ホルモン(thyroid hormone: TH)
甲状腺で合成されるチロキシン(T4)やトリヨードチロニン(T3)。核内受容体の一種である甲状腺ホルモン受容体(TR)を介してさまざまな遺伝子の発現を制御する。両生類の変態においては、消化管を含むほとんどの器官のリモデリングにかかわる重要な因子。
※6 モデル動物
生物学において長く研究に用いられ、知見が蓄積されてきた動物。脊椎動物の発生生物学では、魚類のゼブラフィッシュやメダカ、両生類のアフリカツメガエルとネッタイツメガエル、鳥類のニワトリ、哺乳類のマウスが代表的。ゲノム情報、実験手法、供給手段、データベースなどの研究基盤が整備されていることが特長。
※7 multi-regional RNA-seq法
RNA-seq法とは特定の組織で発現しているRNAの塩基配列を網羅的に次世代シークエンサーにより解読し、発現する遺伝子の種類と発現量を明らかにする手法。multi-regional RNA-seqとは複数の領域から抽出したRNAで行うRNA-seq法で、領域間の遺伝子発現の違いを解析する。
■論文情報
| 論文タイトル | Histological and gene-expression analyses of pyloric sphincter formation during stomach metamorphosis in Xenopus laevis (アフリカツメガエルの胃の変態における幽門括約筋形成の組織学と遺伝子発現解析) |
| 掲載誌 | 国際学術誌 「Developmental biology」オンライン版(Impact Factor: 2.5) |
| 掲載日 | 2024年9月21日(土) |
| 著者 | (1共同筆頭著者、2責任著者) Kei Nagura1, Takafumi Ikeda1, Takashi Hasebe, Yumeko Satou-Kobayashi, Sumio Udagawa, Shuji Shigenobu, Atsuko Ishizuya-Oka, Masanori Taira2 |
| DOI | 10.1016/j.ydbio.2024.09.010 |
■研究者一覧(所属先は特記ない限り2024年10月1日 現在)
名倉 京:東京大学大学院理学系研究科生物科学専攻(研究当時)
池田 貴史:京都産業大学タンパク質動態研究所研究員
佐藤-小林 夢子:帝京大学先端総合研究機構助教
宇田川 澄生:お茶の水女子大学湾岸生物教育研究所特任助教
重信 秀治:基礎生物学研究所教授
長谷部 孝:日本医科大学生物学教室教授
岡 敦子:日本医科大学生物学教室教授(研究当時、現名誉教授)
平良 眞規:東京大学大学院理学系研究科生物科学専攻准教授(研究当時、現中央大学)
(本研究のデータは、東京大学、日本医科大学、基礎生物学研究所、で得たもの)
■謝辞
本研究は、笹川科学研究助成、日本学術振興会科学研究費助成事業(課題番号:JP 25251026)および基礎生物学研究所共同利用研究(課題番号:18-414)の支援を受けて実施されました。
【研究に関する問い合わせ】
京都産業大学タンパク質動態研究所研究員 池田 貴史(いけだ たかふみ)
TEL:075-705-2965
E-mail:ikedat[アット]cc.kyoto-su.ac.jp
中央大学 平良 眞規(たいら まさのり)
TEL:03-3817-7167
E-mail:m-taira.183[アット]g.chuo-u.ac.jp
【報道に関する問い合わせ】
京都産業大学 広報部
TEL:075-705-1411 FAX : 075-705-1987
E-mail:kouhou-bu[アット]star.kyoto-su.ac.jp
※[アット]を「@」に変換して送信してください。
■添付資料
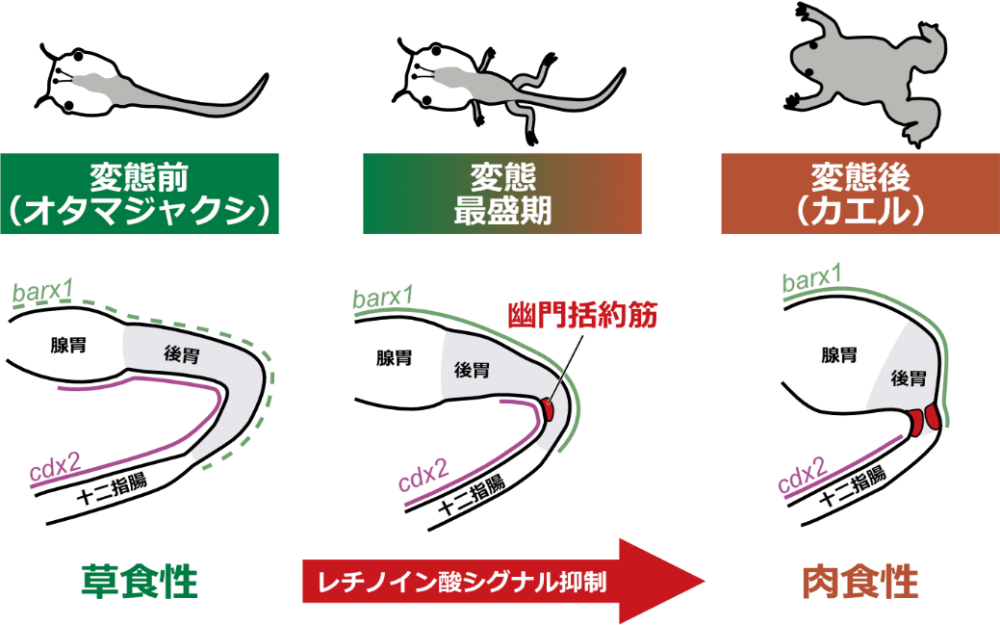
図1 本研究結果の概要
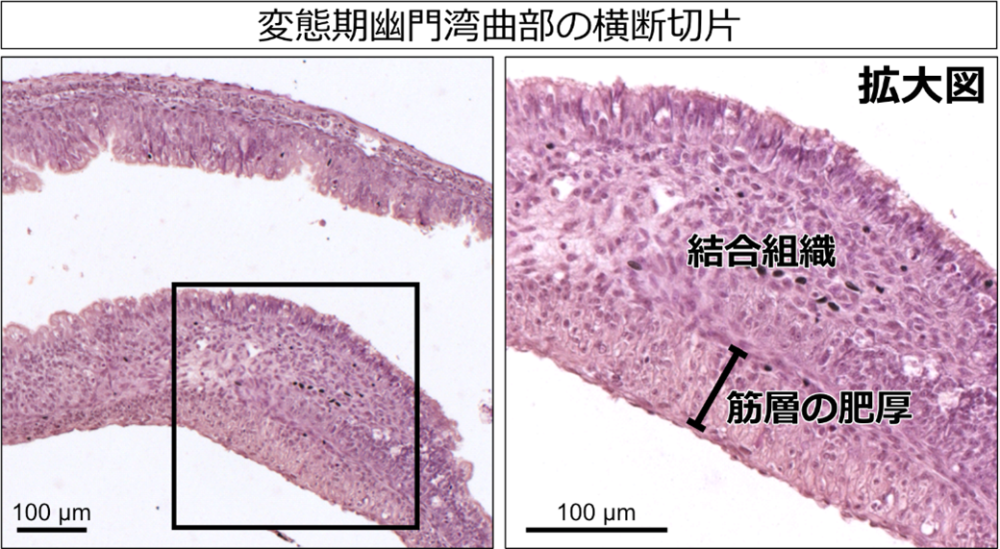
図2 幽門括約筋形成の開始位置
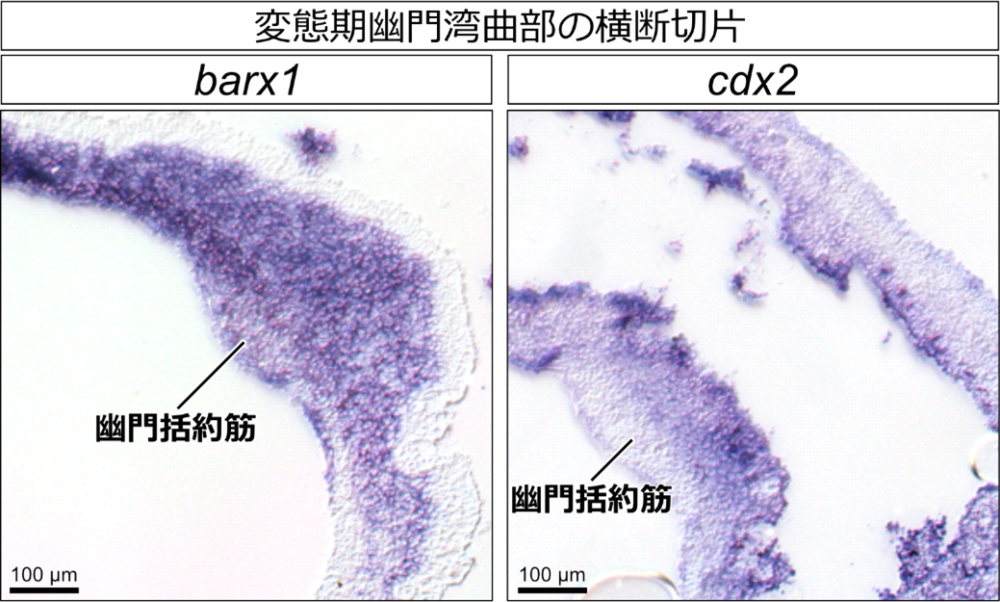
図3 幽門湾曲部におけるbarx1とcdx2の重複発現
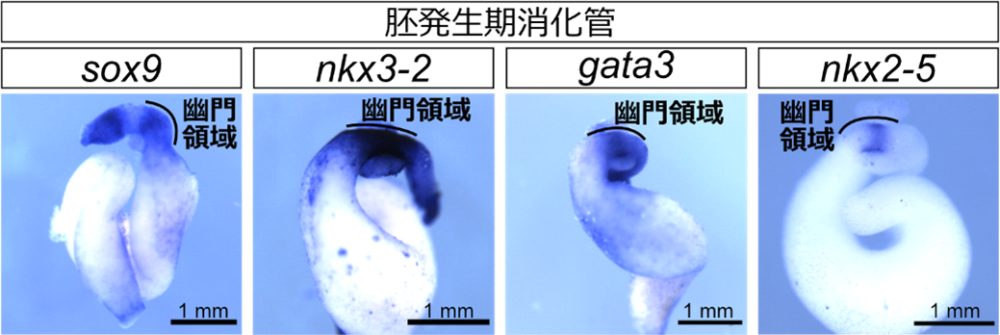
図4 胚発生期の幽門部における各種遺伝子の発現
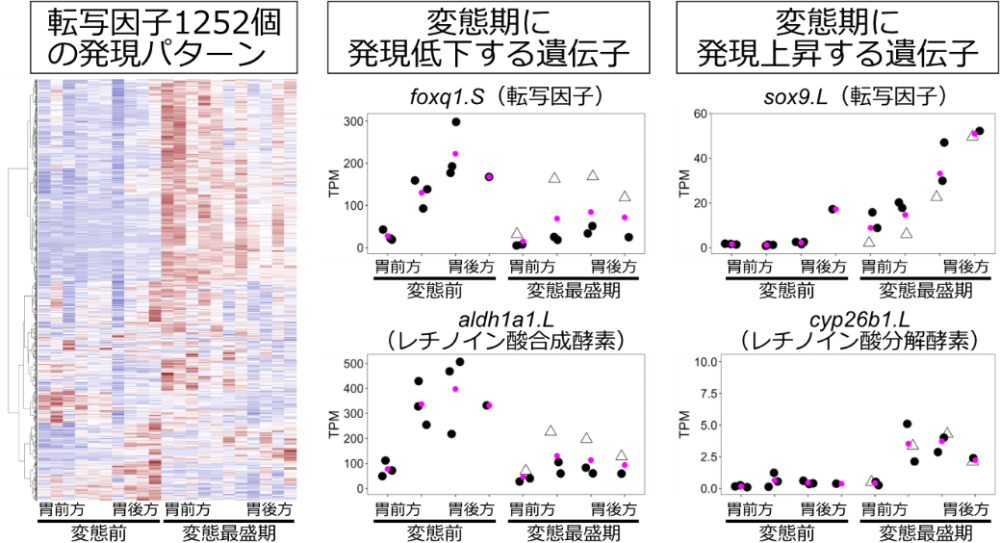
図5 RNA-seq法による変態期における発現変動遺伝子の同定 アフリカツメガエルは異質四倍体なので、各遺伝子は基本的に2個ずつあり、それらを .L と .S で区別して表記する。
